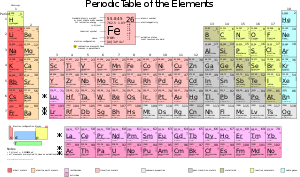
Закон периодической системы химических элементов – это фундаментальный закон, который описывает упорядоченное расположение элементов по возрастающему атомному номеру и атомной массе и раскрывает их физические и химические свойства. Этот закон является одной из важнейших составляющих химической науки и тесно связан с понятиями периодов, групп, блоков, атомных свойств и многими другими.
Периодический закон был разработан в 1869 году Дмитрием Менделеевым и онлайна Генри Главном и является результатом многолетних исследований и экспериментов ученых. Главная идея этого закона заключается в том, что свойства элементов повторяются с определенным периодичностью, т.е. через определенное количество элементов свойства повторяются. Это позволяет глубже понять закономерности и особенности взаимодействия элементов в химических реакциях и предсказать новые свойства и их применение.
Ключевым понятием в периодической системе является понятие периода и группы. Всего в периодической системе присутствуют 118 элементов, которые поделены на 7 периодов и 18 групп. Каждый период характеризуется увеличением числа электронных оболочек, а каждая группа – одинаковым количеством электронов во внешней оболочке. Это позволяет классифицировать элементы, определить их подобные свойства и группировать их вотличные группы.
Кроме того, в периодической системе характеризуются также блоки элементов – s-, p-, d- и f-блоки. Они отображают особенности расположения электронов в атомах элементов и определяют их химические свойства. Также в периодической системе имеется классификация элементов на металлы, полуметаллы и неметаллы. Все эти понятия и классификации позволяют более глубоко изучать и понимать природу и свойства химических элементов.
Закон периодической системы химических элементов
Основная идея закона периодической системы заключается в том, что элементы располагаются в порядке возрастания атомных номеров, а их химические свойства меняются в циклическом порядке. Вся таблица имеет форму прямоугольника, разделенного на строки (периоды) и столбцы (группы).
Каждая горизонтальная строка таблицы периодов соответствует новому энергетическому уровню электронов, а каждый вертикальный столбец таблицы группам элементов схожими свойствами. Таким образом, группы по вертикали имеют одинаковое количество внешних электронов, что определяет их химические свойства.
Закон периодической системы химических элементов позволяет систематизировать и классифицировать все известные элементы и предсказывать свойства еще не открытых элементов. Благодаря этому закону химический элементарный шаблон распределен по таблице периодически, что облегчает изучение свойств элементов и поиск закономерностей в их химическом поведении.
Важно отметить, что закон периодической системы химических элементов был открыт и развит многими учеными, включая Дмитрия Менделеева, который в 1869 году предложил основополагающую табличную форму периодической системы элементов, основанную на их атомных массах и химических свойствах.
История открытия и развития
История открытия и развития периодической таблицы химических элементов начинается с первых научных исследований и открытий в области химии.
Первым принципиальным открытием в этой области стала идея о существовании элементов, из которых состоит материя. В 1789 году французский химик Антуан Лоран Лавуазье предложил название «химические элементы» для обозначения различных видов веществ.
Первые попытки систематизировать элементы осуществили другие ученые, такие как Й.В. Дёберейнер, А.Э. Чеховский и Д.М.Менделеев. Однако основополагающим шагом в развитии периодической системы стало открытие различных закономерностей в химических свойствах элементов.
В 1869 году русский химик Д.И. Менделеев разработал первую периодическую систему химических элементов, основанную на их атомных массах и последовательности периодов. В этой системе элементы были упорядочены по возрастанию атомных масс, и ученый предсказал свойства еще неизвестных на тот момент элементов.
- Периодическая таблица Д.И. Менделеева стала основой для дальнейших исследований и получила широкое признание в научном мире.
- С течением времени были открыты новые элементы, и периодическая таблица постоянно дополнялась и обновлялась.
- В 20 веке были открыты трансурановые элементы и синтезированы искусственные элементы.
Современная периодическая система включает в себя 118 элементов, расположенных по возрастанию атомных номеров и группированных похожими свойствами.
История открытия и развития периодической таблицы является неотъемлемой частью развития химии и оказывает важное влияние на многочисленные области науки и технологий.
Принципы организации
Главным принципом организации периодической таблицы является упорядочение элементов по возрастанию атомного номера. Атомный номер определяется количеством протонов в ядре атома и служит основной характеристикой элемента.
Периодическая таблица также разделена на периоды и группы. Периоды представляют собой горизонтальные строки элементов, которые имеют одинаковое количество энергетических уровней электронов. Группы представляют собой вертикальные столбцы элементов, которые имеют аналогичную конфигурацию электронных оболочек.
Каждый элемент в периодической таблице имеет свое химическое обозначение, которое представляется символом или символами. Отдельные элементы в таблице могут иметь дополнительную информацию, такую как атомная масса и электронная конфигурация. Также, они могут быть расположены в различных блоках в зависимости от их свойств и характеристик, таких как металлы, неметаллы и полуметаллы.
Принцип организации периодической таблицы позволяет увидеть закономерности и тенденции свойств химических элементов. Он также помогает ученым предсказывать свойства и поведение элементов, а также искать новые закономерности и тенденции в химических реакциях и соединениях.
| Периоды | Группы |
|---|---|
| Первый | Группа 1 (щелочные металлы) |
| Второй | Группа 2 (щелочноземельные металлы) |
| Третий | Группа 13 (боровые группы) |
| Четвертый | Группы 14-18 (углеродные группы и инертные газы) |
| Пятый | Группа 15 (азотные группы) |
| Шестой | Группа 16 (кислородные группы) |
| Седьмой | Группа 17 (галогены) |
| Восьмой | Группа 18 (инертные газы) |
Универсальность и применение
Одно из наиболее важных применений периодической таблицы заключается в ее использовании при решении химических задач. С ее помощью можно определить атомную массу элемента, количество протонов, электронов и нейтронов в атоме. Она также позволяет определить электронную конфигурацию атома, что в свою очередь влияет на его химические свойства.
Периодическая таблица также является основой для классификации элементов в химические группы и периоды. Это позволяет нам увидеть общие закономерности и связи между элементами, а также предсказывать их химические свойства. Например, элементы в одной группе обычно имеют схожие химические свойства, такие как способность образовывать ионы определенного заряда или образовывать определенные химические соединения.
Кроме того, периодическая таблица часто используется в области материаловедения и технологий. Изучение химических элементов и их соединений помогает разработать новые материалы с определенными свойствами, такие как прочность, гибкость, проводимость электричества и тепла. Например, изучение свойств различных металлов позволяет выбрать оптимальный материал для изготовления различных конструкций и устройств.
Кроме того, периодическая таблица оказывает влияние на различные отрасли науки и техники, включая медицину, энергетику, экологию и космическую индустрию. Знание свойств элементов позволяет разрабатывать новые лекарственные препараты, улучшать эффективность энергетических процессов, разрабатывать новые экологически чистые материалы и технологии, а также исследовать возможность использования ресурсов космоса.
Таким образом, периодическая таблица является неотъемлемой частью нашего понимания химических элементов и их свойств, а также является основой для различных исследований и прикладных наук.
Периоды и группы
Периоды — это строки, которые горизонтально пересекают таблицу. Всего в таблице Менделеева семь периодов. Каждый следующий период начинается с новой энергетической оболочки. На первом периоде находятся элементы, у которых одна энергетическая оболочка, на втором — две, и так далее. Например, элементы первого периода — водород и гелий, имеют по одной энергетической оболочке, а элементы второго периода — литий, бериллий, бор, углерод и так далее, уже имеют две энергетические оболочки.
Группы — это столбцы в таблице. В таблице Менделеева есть 18 групп. Группы объединяют элементы с похожими химическими свойствами. Например, элементы группы 1, такие как литий, натрий и калий, являются щелочными металлами и обладают схожими свойствами, такими как активность и способность образовывать щелочные гидроксиды.
Таким образом, таблица Менделеева с периодами и группами позволяет увидеть закономерности в строении и свойствах химических элементов и является основой для изучения химии и прогнозирования химических реакций.
Определение периодов и групп
Периоды представляют собой горизонтальные ряды элементов, расположенные в таблице Менделеева. Их номера соответствуют главным квантовым числам электронных оболочек этих элементов. Например, первый период состоит из элементов, у которых внешняя электронная оболочка имеет одну электронную подоболочку. Второй период состоит из элементов с двумя электронными подоболочками и так далее.
Группы представляют собой вертикальные столбцы элементов в таблице Менделеева. Их номера указывают на количество электронов на внешней электронной оболочке элементов в данной группе. Например, группа 1 представляет собой щелочные металлы, у которых на внешней оболочке один электрон, а группа 18 — инертные газы, у которых на внешней оболочке 8 электронов.
Знание периодов и групп позволяет установить некоторые закономерности в свойствах элементов. Например, элементы в одной группе обладают схожими химическими свойствами из-за одинакового количества электронов на внешней электронной оболочке. Также, при переходе по периоду свойства элементов изменяются последовательно из-за изменений в строении атомов.
Определение периодов и групп является основой для понимания строения и свойств химических элементов. Оно помогает предсказывать и объяснять химические реакции и поведение элементов в различных условиях.
Свойства элементов в периодической таблице
Атомный номер — это число, которое показывает количество протонов в атоме элемента. Оно определяет положение элемента в периодической таблице. Чем больше атомный номер, тем больше электронов и их энергетических уровней у элемента.
Массовое число — это сумма протонов и нейтронов в атомном ядре элемента. Оно также играет роль в определении положения элемента в таблице и его химических свойств.
Периоды — это горизонтальные ряды элементов в периодической таблице. Каждый период соответствует новому энергетическому уровню электронов. Всего существует семь периодов, от 1 до 7.
Группы — это вертикальные столбцы элементов в таблице. Группы помогают классифицировать элементы по их химическим свойствам. Некоторые элементы в одной группе имеют схожие свойства и могут образовывать аналогичные соединения.
Блоки элементов, такие как s-блок, p-блок, d-блок и f-блок, также являются важными понятиями в периодической таблице. Они связаны с расположением электронов и химическими свойствами элементов.
Свойства элементов могут быть химическими и физическими. Химические свойства включают способность образовывать соединения, схожие свойства реакции и реакцию с другими элементами. Физические свойства включают плотность, температуру плавления и кипения, электрическую проводимость и др.
Различия в свойствах элементов в таблице объясняются их атомной структурой и электронной конфигурацией. Атомы с одинаковым числом электронов на внешнем энергетическом уровне (валентные электроны) имеют схожие химические свойства.
Химические свойства групп элементов
Химические свойства элементов в периодической таблице периодического закона можно классифицировать по группам элементов. Группы элементов имеют схожие химические свойства из-за аналогичной валентности электронов в их внешней электронной оболочке.
Группа 1 элементов, также известная как щелочные металлы, характеризуется высокой реактивностью из-за ионизации своего единственного валентного электрона. Эти элементы легко образуют ионы с положительным зарядом и реагируют с водой, кислородом и галогенами.
Группа 2 элементов, или щёлочноземельные металлы, имеет два валентных электрона и обладает схожими свойствами со щелочными металлами, но менее реактивными.
Группы 3-12 представляют собой блок переходных металлов, которые обладают разнообразными химическими свойствами. Они образуют ионы с различными валентностями и могут образовывать сложные соединения. Переходные металлы могут быть хорошими катализаторами реакций.
Группа 13 элементов, или тройка, включает элементы, имеющие три валентных электрона. Эти элементы проявляют кислотные свойства, реагируя с основаниями, образуя соли.
Группа 14 представлена углеродом, кремнием и другими полуметаллами. Углерод способен образовывать длинные цепочки атомов, что делает его уникальным в отношении своих химических свойств.
Группы 15-18 включают неметаллы и инертные газы. Неметаллы образуют отрицательно заряженные ионы и часто образуют соединения с металлами, чтобы достичь стабильности. Инертные газы, такие как гелий и неон, практически не реагируют с другими элементами из-за своей стабильной электронной конфигурации.
Изучение химических свойств элементов по группам позволяет лучше понять и предсказать их поведение в реакциях и их роль в химических процессах.
Вопрос-ответ:
Каково определение периодического закона в химии?
Периодический закон в химии — это закономерность, согласно которой свойства химических элементов периодически повторяются в зависимости от их атомной структуры.
Какие свойства химических элементов повторяются в периодическом законе?
В периодическом законе повторяются такие свойства, как атомный радиус, ионизационная энергия, электроотрицательность, химическая активность и другие.
Каково значение периодического закона для химии?
Периодический закон имеет огромное значение для химии, так как он позволяет систематизировать и классифицировать химические элементы, предсказывать их свойства и создавать новые вещества.
Как было установлено существование периодического закона?
Существование периодического закона было установлено благодаря исследованиям Д.И. Менделеева и Ю.А. Менделеева. Они основали периодическую систему химических элементов и предложили периодический закон.
Что означают термины ‘период’ и ‘группа’ в периодическом законе?
В периодическом законе термин ‘период’ означает горизонтальную строку в периодической таблице, а термин ‘группа’ — вертикальную колонку.
Что такое закон периодического закономерности химических элементов?
Закон периодического закономерности химических элементов — это закономерность, согласно которой свойства химических элементов повторяются периодически при возрастании их атомных номеров.