Периодический закон — основной закон химии, определяющий закономерные изменения свойств элементов, обусловленные их атомными структурами и положением в периодической системе.
Основой принципа действия периодического закона является классификация элементов по возрастанию атомного номера, отражающая регулярные закономерности в их химических свойствах. В основе этого закона лежит концепция атомного строения, согласно которой организация электронной оболочки атома определяет его поведение при взаимодействии с другими атомами.
Периодический закон выражается в том, что свойства химических элементов изменяются периодически при движении по периодам и группам периодической системы. Это объясняется изменением основных параметров атомов, таких как радиус, ионизационная энергия, электроотрицательность, атомные и ионные радиусы и других. Элементы периодической системы подразделяются на главные группы и подгруппы в соответствии с закономерными изменениями указанных характеристик.
Периодический закон
Согласно периодическому закону, в размещении элементов в таблице Менделеева каждая вертикальная колонка представляет собой одну химическую группу. Элементы одной группы имеют схожие химические свойства, что обусловлено наличием одинакового количества валентных электронов во внешней оболочке атома.
Горизонтальные ряды таблицы Менделеева соответствуют периодам. Каждый последующий период начинается с элемента, обладающего электронной оболочкой, содержащей одно электронное облако больше, чем у предыдущего элемента. Периодический закон определяет, что с ростом атомного номера у элементов по горизонтали меняются их химические свойства и физические характеристики.
Периодический закон позволяет классифицировать и систематизировать все известные элементы, а также предсказывать свойства новых элементов, которые могут быть синтезированы в лаборатории или найдены природным путем.
| Период | Группа 1 | Группа 2 | Группа 3 | Группа 4 | Группа 5 | Группа 6 | Группа 7 | Группа 8 | Группа 9 | Группа 10 | Группа 11 | Группа 12 | Группа 13 | Группа 14 | Группа 15 | Группа 16 | Группа 17 | Группа 18 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | H | He | ||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||
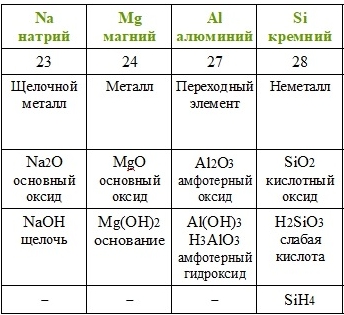
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| 6 | Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
Приведенная выше таблица Менделеева иллюстрирует применение периодического закона. Она показывает упорядоченное расположение элементов по периодам и группам в соответствии с их атомными номерами и химическими свойствами.
Таким образом, периодический закон является основополагающим принципом химии, который позволяет систематизировать и классифицировать химические элементы, исследовать их свойства и предсказывать новые.
Что такое периодический закон?
Основой для построения периодической таблицы элементов считается классификация элементов по порядку возрастания их атомных номеров. Согласно периодическому закону, химические элементы могут быть разделены на периоды и группы.
Период — это горизонтальный ряд элементов в периодической таблице. На каждом последующем периоде электроны заполняют новый энергетический уровень. Изменение периода соответствует изменению внешней оболочки атома.
Группа — это вертикальный столбец элементов в периодической таблице. Все элементы в одной группе имеют одинаковое число электронов во внешней оболочке. Поэтому элементы в одной группе имеют сходные свойства и химические реакции.
Периодический закон позволяет установить связи между разными элементами, предсказывать их химические свойства и поведение в реакциях. Этот закон является основой для понимания и изучения химии и является одной из ключевых тем в образовательной программе по химии.
Важно отметить, что периодический закон был открыт и систематизирован деятелем русской науки Дмитрием Ивановичем Менделеевым в 1869 году. Его заслуга заключается в создании первой версии периодической таблицы элементов, которая с учетом периодического закона предсказывала свойства и место новых элементов.
| Группа | 1 | 2 | 3 | … | 18 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Период 1 | H | ||||||||||||||||
| Период 2 | Li | Be | |||||||||||||||
| Период 3 | Na | Mg | |||||||||||||||
| … | … | … | … | … | … | ||||||||||||
Определение периодического закона
Периодический закон предполагает, что элементы, расположенные на одной вертикальной группе (столбце) таблицы Менделеева, обладают схожими химическими свойствами и имеют аналогичную электронную конфигурацию. В то же время, элементы, расположенные на одной горизонтальной периоде (строке), характеризуются возрастающим атомным номером и изменяющимися свойствами.
Основой периодического закона является расположение элементов в таблице Менделеева, в которой элементы упорядочены по возрастанию атомного номера и группированы в периоды и группы в соответствии с их химическими и физическими свойствами. Периодический закон является фундаментальной основой для изучения и понимания синтеза соединений, анализа химических реакций и прогнозирования свойств новых элементов.
Сущность периодического закона
Суть периодического закона заключается в том, что химические и физические свойства элементов имеют тенденцию меняться периодически в соответствии с их атомными номерами. Это значит, что свойства элементов зависят от их расположения в периодической таблице элементов.
Периодический закон предсказывает, что определенные химические свойства элементов могут повторяться каждые n элементов, где n — номер периода. Это также связано с расположением элементов в группах, где элементы схожи по своим химическим свойствам.
Сущность периодического закона заключается в установлении систематики и порядка в химических элементах, что позволяет исследователям классифицировать и предсказывать химическое поведение элементов, а также создавать новые соединения и материалы с желаемыми свойствами.
Принцип действия периодического закона
Периодический закон основан на расположении элементов в таблице Менделеева. Таблица Менделеева представляет собой систематическое упорядочение элементов по возрастанию их атомных номеров и химических свойств. Она состоит из строк, называемых периодами, и столбцов, называемых группами.
Одним из ключевых элементов периодического закона является принцип заполнения электронных оболочек атомов. Каждый атом состоит из электронов, расположенных на определенных энергетических уровнях, называемых оболочками. На каждой оболочке может находиться определенное количество электронов.
Периодическое повторение свойств элементов объясняется тем, что при увеличении атомного номера в таблице Менделеева увеличивается количество электронов в атоме. Каждая новая строка периодической системы соответствует заполнению следующей электронной оболочки. К примеру, первая периодическая строка соответствует заполнению первой электронной оболочки, вторая — заполнению второй оболочки и так далее.
Принцип действия периодического закона можно проиллюстрировать с помощью таблицы Менделеева. В таблице элементы расположены в порядке возрастания атомного номера, а также сгруппированы по сходным химическим свойствам. Это расположение позволяет предсказывать и объяснять химические свойства элементов и их соединений.
| Группы | Периоды |
|---|---|
| 1 | 1 |
| 2 | 2 |
| 3 | 3 |
| … | … |
Таким образом, принцип действия периодического закона заключается в том, что химические свойства элементов и их соединений периодически меняются при изменении атомного номера и соответствующем заполнении новых электронных оболочек.
Основные принципы периодического закона
- Первый принцип периодического закона заключается в постепенном изменении химических свойств элементов при движении от одной группы к другой в таблице Менделеева. Элементы в одной и той же группе имеют схожие свойства, такие как валентность и типы химических соединений, которые они могут образовывать.
- Второй принцип заключается в том, что у элементов, находящихся в одной периоде таблицы Менделеева, увеличивается атомный радиус и электроотрицательность при движении от левого к правому краю периоды. Это связано с увеличением количества электронных оболочек и эффективным притяжением электронов ядрами атомов.
- Третий принцип заключается в том, что химические свойства элементов периодически повторяются через каждые определенное количество элементов, называемое периодом. Это связано с заполнением электронных оболочек электронами в атомах.
- Четвертый принцип заключается в том, что химические свойства элементов, находящихся в одной группе таблицы Менделеева, схожи из-за одинакового числа электронов на внешней энергетической оболочке. Это определяет валентность элементов и их способность образовывать химические соединения.
Основные принципы периодического закона позволяют упорядочить химические элементы и обеспечить понимание их свойств и взаимодействий.
Механизм действия периодического закона
Периодический закон химических элементов объясняет систематическое повторение свойств элементов в таблице химических элементов, известной как таблица Менделеева. Механизм действия периодического закона основан на структуре атома и его электронной конфигурации.
Атом состоит из положительно заряженного ядра, в котором содержатся протоны и нейтроны. Вокруг ядра находятся электроны, заряженные отрицательно. Основной идеей периодического закона является то, что свойства химических элементов определяются электронной конфигурацией атомов.
Электроны размещаются в атоме по энергетическим уровням и подуровням. В основном в ближайший к ядру уровень попадают 2 электрона, на второй — 8, на третий — 8, и так далее. Такая конфигурация обусловлена принципом заполнения электронных оболочек наименьшей энергией.
Периодический закон объясняет, каким образом изменяются свойства элементов по мере движения вдоль периодов и столбцов таблицы Менделеева. По мере увеличения атомного номера элемента, его электронная конфигурация постепенно изменяется, что приводит к изменению химических и физических свойств элементов. Таким образом, периодический закон позволяет предсказывать свойства элемента на основе его положения в таблице Менделеева.
Значимость периодического закона
Одним из основных принципов периодического закона является постоянное повторение пропорций свойств элементов вдоль периодов и групп таблицы Менделеева. Это позволяет легко определить многие характеристики элементов, такие как радиус атома, электроотрицательность, сродство к электрону и др.
Значимость периодического закона проявляется не только в области химии, но и в других научных исследованиях. Например, благодаря пониманию периодического закона, учёным удалось разработать новые материалы и соединения, которые находят применение в различных областях, от электроники до металлургии.
Периодический закон является неотъемлемой частью образования в области химии. Понимание его принципов помогает студентам и научным работникам увидеть закономерности и связи между элементами и использовать эту информацию для более глубокого понимания химических процессов.
Важно отметить, что периодический закон все еще остается предметом исследований и развития. Ученые постоянно находят новые закономерности и нюансы, что способствует углублению нашего понимания мира элементов и их связей.
Поэтому, периодический закон является одним из важнейших искусств человечества, которое помогает нам расширить наши знания о микромире и использовать их для создания новых технологий и достижений.
Вопрос-ответ:
Что такое периодический закон?
Периодический закон — это основополагающий принцип в химии, согласно которому свойства химических элементов периодически повторяются при увеличении их атомных номеров.
Какие свойства химических элементов периодически повторяются?
Среди свойств, которые периодически повторяются, можно выделить такие характеристики, как радиус атома, электроотрицательность, ионизационная энергия, электроаффинность, химическая активность и многие другие.
В чем причина периодического закона?
Периодический закон объясняется электронной структурой атомов. При увеличении атомных номеров электроны добавляются по порядку в различные энергетические уровни и подуровни, что приводит к появлению новых периодов и групп таблицы химических элементов.
Какие элементы можно найти во всех периодах таблицы?
Во всех периодах таблицы химических элементов можно найти элементы водород и гелий. Они обладают особенностями в своей электронной структуре, что делает их исключением из общего правила периодического закона.